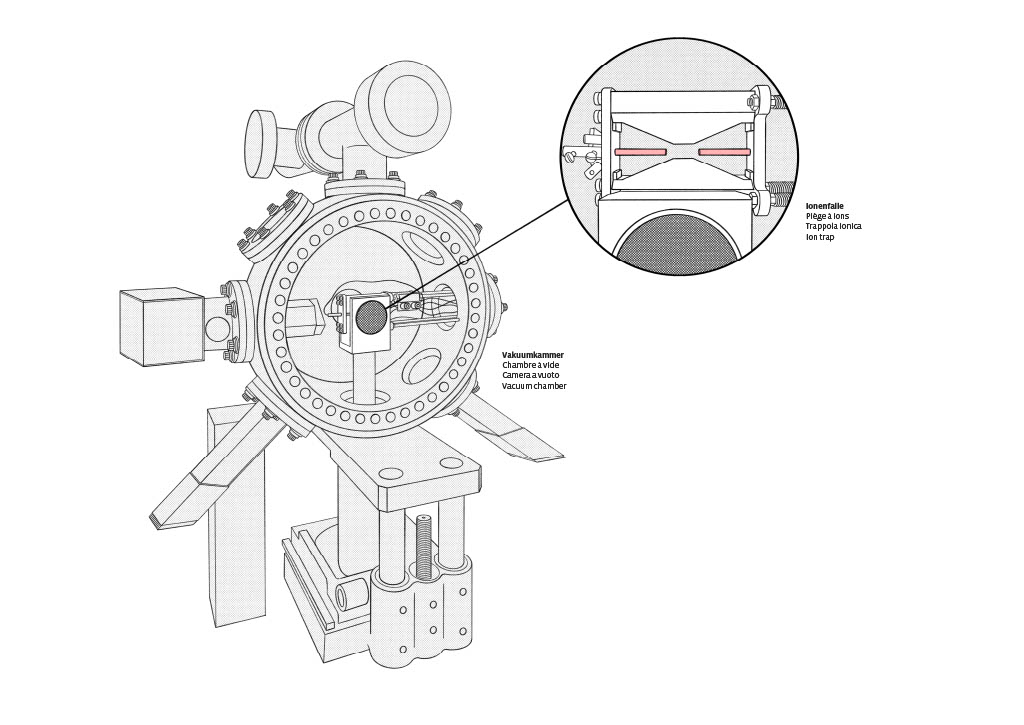
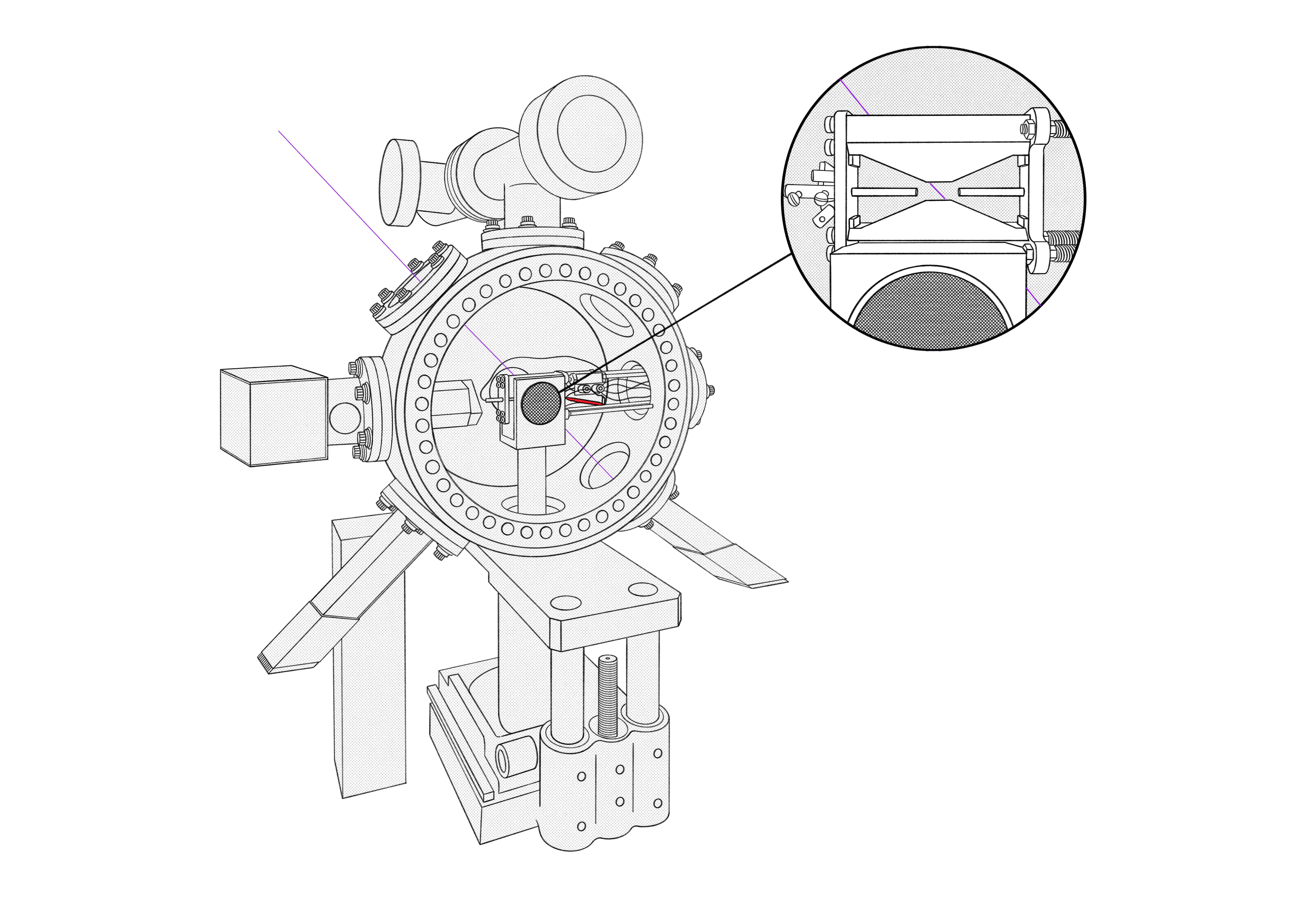
Im Swiss Science Center Technorama befindet sich das Exponat, das du gerade benutzt. Was du auf der Webcam siehst, sind tatsächlich einzelne geladene Atome, sogenannte Ionen des Bariums. Um diese Ionen jedoch SEHEN zu können, muss man sie zuerst einfangen.
Im Mittelpunkt des Exponats steht eine so genannte Ionenfalle - ein Gerät, das elektrische Felder nutzt, um Ionen einzufangen. Dieses spezielle Experiment wurde in der Trapped Ion Quantum Information Group an der ETH Zürich entwickelt.